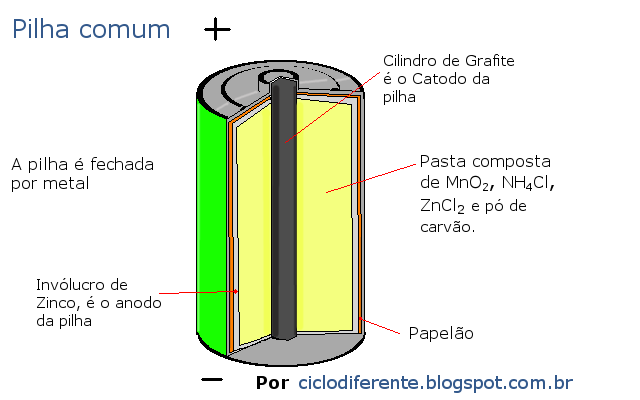
Pilhas
É um dispositivo que utiliza as reações de oxidação e
redução para converter energia química em elétrica. Em que a energia química
utilizada será sempre espontânea.
Tem dois eletrodos que são constituídos de metais
diferentes, que fornecem a superfície na qual ocorrem as reações de oxidação e
redução. Os eletrodos encontram-se cada um em um compartimento separado um do
outro podendo ser separado por uma placa membrana porosa por argila não
vitrificada, porcelana ou outros materiais, esses eletrodos são imersos em uma
solução aquosa. O compartimento tem a finalidade de separar os dois reagentes
participantes da reação de óxido-redução, pois se não tivesse, os elétrons seriam
transferidos diretamente do agente redutor para o agente oxidante. Quando os
dois eletrodos são conectados por um circuito elétrico externo, um fio
condutor, localizado fora da célula, verifica-se o fluxo de elétrons entre os
eletrodos.
Os elétrons fluem do anodo (eletrodo negativo) para o catodo
(eletrodo positivo), sendo que o sentido da corrente elétrico. Importante saber
a direção do fluxo, pois na Física acontece o inverso, o fluxo é do catodo para
o anodo.
História da Pilha
Com a invenção da máquina que “produz” eletricidade por Otto
Von Guericke no século XVII, Luigi Aloisio Galvani na segunda metade do século
XVIII, começou a pesquisar sobre a aplicação terapêutica da eletricidade. Após
10 anos de pesquisa ele publicou Sobre as forças de eletricidade nos movimentos
musculares, onde concluiu que os músculos armazenavam eletricidade, e os nervos
conduziam eletricidade. É o famoso experimento realizado em pernas de rã,
Galvani ligava um circuito elétrico nas pernas e elas se contraia.
No século XVIII, Alessandro Volta verificou que, se dois
metais diferentes forem postos em contato um com o outro, um dos metais fica ligeiramente
negativo e outro ligeiramente positivo. E com isso estabelece-se entre os
metais uma diferença de potencial, ou seja, uma tensão elétrica. Usando esta
experiência como base, ele idealizou uma pilha, a que deu o nome de pilha
voltaica, em referência a seu sobrenome.
A pilha de Alessandro era composta por discos de zinco e de
cobre empilhados e separados por pedaços de tecidos embebidos em solução de
ácido sulfúrico.
Funcionamento de uma pilha
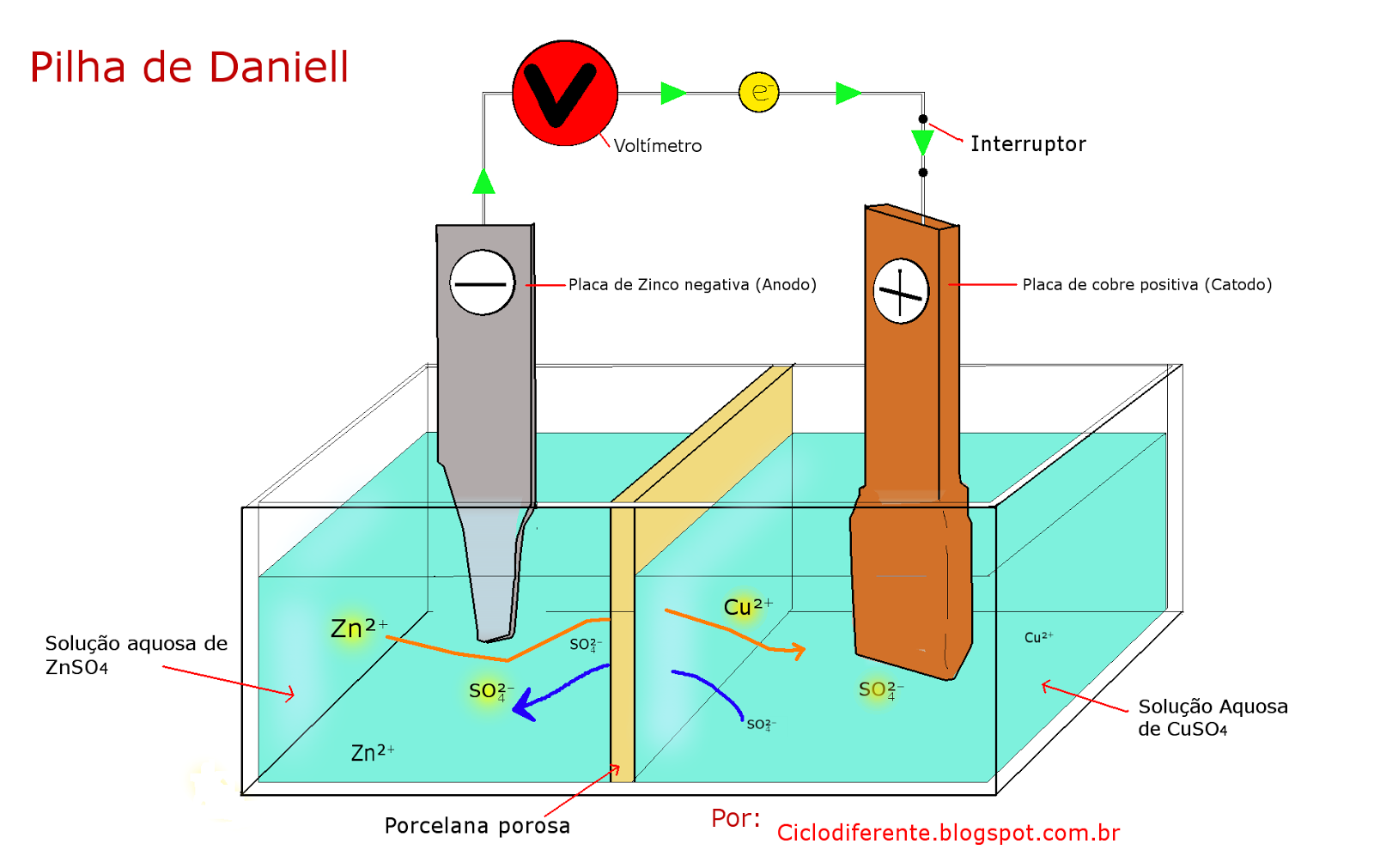
Para isso vamos usar a pilha de Daniel como modelo, é
separado fisicamente a barra de zinco imersa em ZnSO4 de uma barra de cobre
imersa em uma solução aquosa de CuSO4, é acrescentado um fio elétrico e se tem
uma corrente elétrica por conta dos eletrodos (zinco e cobre) fornecerem as
reações de oxidação e redução.
Acervo próprio
Se quiser abrir a imagem apenas clique nela.
Na meia-célula da esquerda (meia-célula do zinco) temos a
reação (chamada de semirreação do zinco):
Em contato com o cobre metálico o zinco
perde dois elétrons de cada átomo, que correm pelo fio em direção ao cobre.
No meia-célula da direita (meia-célula do
cobre) temos a reação:
Os íons de cobre recebem os elétrons do zinco e fica neutro,
ele estava positivo por conta da solução aquosa de CuSO4 que torna-se em íons
Cu²+ e SO4, os íons Cu depositam se no cobre metálico. Em contrapartida para equilibrar essas
reações, passa-se pela placa porosa os íons Zn² para a meia-célula da direita
(do cobre) e desta meia-célula partem os íons SO4 pela placa porosa em direção
a meia-célula da esquerda (do zinco).
Então no funcionamento da pilha de Daniel temos:
- fluxo de elétrons em direção do zinco para o cobre;
- fluxo de íons em direção da meia-célula da direita para a
esquerda.
Quando se abre o interruptor, todo o processo para
imediatamente.
Depois de algum tempo de funcionamento verificamos que:
Acervo próprio
Se quiser abrir a imagem apenas clique nela.
Se quiser abrir a imagem apenas clique nela.
- O eletrodo de zinco foi corroído;
- O eletrodo de cobre teve sua massa aumentada por conta dos
íons da solução se aglomerarem nele;
- A solução de CuSO4 ficou diluída;
- A solução de ZnSO4 ficou concentrada;
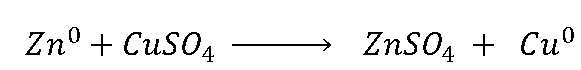
A partir das reações que acontece na pilha podemos montar
uma reação global de funcionamento da pilha:


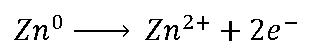
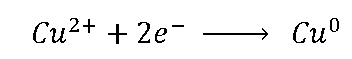
Nenhum comentário:
Postar um comentário