As enzimas são substâncias orgânicas, estão por diversas áreas da vida, desempenham papéis muito importante, e de maneira nenhuma podem ser esquecidas, são geralmente proteínas, que catalisam reações biológicas pouco espontâneas e muito lentas. O poder catalítico de uma enzima relaciona a velocidade das reações com a energia despendida para que elas aconteçam.
Assim, na presença de uma enzima catalisadora, a velocidade da reação é mais rápida e a energia utilizada é menor. Por esse motivo as enzimas praticamente regem todo o funcionamento celular interno, favorecendo o metabolismo anabólico (construção) e catabólico (degradação), bem como externo, através de sinalizadores catalíticos estimulantes ou inibitórios atuantes em outras células (hormônios, por exemplo).
Existem no organismo diferentes tipos enzimáticos, reguladores das diversas vias metabólicas, estendendo-se por todo o corpo humano, no entanto em pequenas quantidades.
A grande especificidade de uma enzima é determinada pelo tamanho e forma tridimensional, formando regiões de afinidade com os reagentes (substratos). A essa complementaridade, denominamos combinação chave-fechadura.
Assim, na presença de uma enzima catalisadora, a velocidade da reação é mais rápida e a energia utilizada é menor. Por esse motivo as enzimas praticamente regem todo o funcionamento celular interno, favorecendo o metabolismo anabólico (construção) e catabólico (degradação), bem como externo, através de sinalizadores catalíticos estimulantes ou inibitórios atuantes em outras células (hormônios, por exemplo).
Existem no organismo diferentes tipos enzimáticos, reguladores das diversas vias metabólicas, estendendo-se por todo o corpo humano, no entanto em pequenas quantidades.
A grande especificidade de uma enzima é determinada pelo tamanho e forma tridimensional, formando regiões de afinidade com os reagentes (substratos). A essa complementaridade, denominamos combinação chave-fechadura.
Atividade enzimática
As enzimas convertem uma substância, chamada de substrato, noutra denominada produto, e são extremamente específicas para a reação que catalisam. Isso significa que, em geral, uma enzima catalisa um e só um tipo de reação química. Consequentemente, o tipo de enzimas encontradas numa célula determina o tipo de metabolismo que a célula efetua.A velocidade da reação catalisada por uma enzima é aumentada devido ao abaixamento da energia de ativação necessária para converter o substrato no produto. O aceleramento da reação pode ser da ordem dos milhões de vezes: por exemplo, a enzima orotidina-5'-fosfato descarboxilase diminui o tempo da reação por ela catalisada de 78 milhões de anos para 25 milissegundos. Como são catalisadores, as enzimas não são consumidas na reação e não alteram o equilíbrio químico dela.
A atividade enzimática pode depender da presença de determinadas moléculas, genericamente chamadas cofatores. A natureza química dos cofatores é muito variável, podendo ser, por exemplo, um ou mais ions metálicos (como o ferro), ou uma molécula orgânica (como a vitamina B12). Estes cofatores podem participar ou não diretamente na reação enzimática.
Determinadas substâncias, podem inibir a atividade de algumas enzimas, diminuindo-a ou eliminando-a totalmente; são os chamados inibidores enzimáticos.
Pelo fato de serem proteínas com estrutura terciária ou quaternária, os enzimas são dotadas de dobramentos tridimensionais em suas cadeias polipeptídicas, o que lhes confere uma forma característica e exclusiva. Assim, diferentes enzimas têm diferentes formas e, portanto, diferentes papéis biológicos. Para que um enzima atue, é necessário que os substratos "se encaixem" na enzima. Esse "encaixe", porém, depende da forma, isto é, do "contorno" da enzima. Por isso, substratos que se "encaixam" em uma determinada enzima não se "encaixam" em outras diferentes, e a reação não ocorre; daí a especificidade das enzimas quanto aos substratos em que atuam. Uma vez ocorrido o "encaixe", forma-se o complexo enzima-substrato, que se assemelha ao sistema "chave-fechadura". O local da enzima onde o substrato se "encaixa" é denominado sítio ativo (ou centro ativo). No caso de substâncias que reagem entre si, sob a ação catalisadora das enzimas, a reação é facilitada, tornando-se mais rápida, pois a proximidade entre as moléculas "encaixadas" acelera o processo reativo; após a reação, a enzima desliga-se do substrato e permanece intacta.
História
Era já sabido, entre o final do século XVII e início do século XVIII, que secreções estomacais eram capazes de digerir a carne;era também conhecida a conversão de amido a açúcares pela saliva e extratos vegetais. O mecanismo subjacente a estas transformações não era, no entanto, conhecido.
As enzimas foram descobertas no século XIX, aparentemente por Pasteur, que concluiu que a fermentação do açúcar em álcool pela levedura é catalisada por fermentos. Ele postulou que esses fermentos (as enzimas) eram inseparáveis da estrutura das células vivas do levedo. Pasteur declarou que "a fermentação alcoólica é um ato correlacionado com a vida e organização das células do fermento, e não com a sua morte ou putrefacção"
Em 1878, Wilhelm Kühne empregou pela primeira vez o termo "enzima" para descrever este fermento, usando a palavra grega ενζυμον, que significa "levedar". O termo passou a ser mais tarde usado apenas para as proteínas com capacidade catalítica, enquanto que o termo "fermento" se refere à atividade exercida por organismos vivos.
Em 1897, Eduard Buchner descobriu que os extratos de levedo podiam fermentar o açúcar até álcool e provou que as enzimas envolvidas na fermentação continuavam funcionando mesmo quando removidas das células vivas . Esta descoberta valeu-lhe o prémio Nobel de Química em 1907.
Restava determinar qual a natureza das enzimas. Alguns afirmavam que as proteínas, associadas à actividade enzimática, apenas eram o suporte da verdadeira enzima, e, por si próprias, incapazes de catálise. Em 1926, James B. Sumner purificou e cristalizou a urease, mostrando tratar-se de uma proteína pura, e fez o mesmo, em 1937, para a catalase. A prova final foi feita por Northrop e Stanley em 1930, com o estudo de três enzimas digestivas, a pepsina, a tripsina e a quimotripsina, pelo que receberam o Prémio Nobel da Química em 1946.
J.B.S. Haldane escreveu um tratado intitulado "Enzimas", onde continha a notável sugestão de que as interações por ligações fracas, entre a enzima e seu substrato, poderiam ser usadas para distorcer a molécula do substrato e catalisar a reação.
A cristalização de enzimas purificadas permitiu que as suas estruturas moleculares pudessem ser examinadas por cristalografia de raios X, o que aconteceu primeiro com a lisozima, uma enzima que ocorre na saliva, lágrimas e na clara de ovo e destrói a parede celular de bactérias, em 1965 . Começaram assim a bioquímica e biologia estruturais, que se esforçam por compreender o funcionamento dos enzimas a nível atómico.
A tentativa de compreender o mecanismo da catálise enzimática a nível quântico tem sido facilitada recentemente pelo aumento de capacidade aritmética dos computadores.
Estruturas e mecanismos
Diagrama PDB 1MOO mostrando a Anidrase carbónica II. A esfera a cinzento é um íon de zinco que funciona como cofator no sítio ativo.
As enzimas são proteínas, e podem ter um tamanho desde 62 resíduos de aminoácidos, como é o caso do monómero da enzima 4-oxalocrotonato tautomerase, até um tamanho de 2.500 resíduos, como é o caso da sintase de ácidos gordos. A atividade das enzimas são determinadas pela sua estrutura quaternária. A maioria das enzimas são maiores do que o substrato sobre o qual acuam, e só uma pequena porção da enzima (cerca de 3-4 aminoácidos) está envolvida na catálise. A região que contém estes resíduos catalíticos, que se liga-se ao substrato e que desempenha a reação, é denominada de sítio ativo. As enzimas também podem ter sítios onde se ligam cofatores, que são necessários às reações catalíticas. Algumas enzimas também podem ter sítios de ligações para pequenas moléculas, que são produtos ou substratos, diretos ou indiretos, da reação catalisada. Estas ligações servem para aumentar ou diminuir a atividade da enzima, providenciando um meio de regulação por feedback.
Tal como todas as proteínas, as enzimas são formadas por longas cadeias lineares de aminoácidos que sofrem um enovelamento que tem como resultado um produto com estrutura tridimensional. Cada sequência única de aminoácidos produz também uma estrutura tridimensional única que tem propriedade específicas. Cadeias individuais de proteínas podem por vezes agrupar-se para formar um complexo proteico. A maioria das enzimas pode sofrer desnaturação, isto é, a sua estrutura pode sofrer desagregação e inativação pelo aumento de temperatura, o que provoca alterações na conformação tridimensional da proteína. Dependendo da enzima, a desnaturação pode ter efeitos reversíveis ou irreversíveis.
Cada enzima possui a sua temperatura e pH ideal. A variação desses fatores pode causar desnaturação da proteína, ou seja, perda da função, porém ambos podem influenciar positivamente a velocidade da reação. O pH estimula as ligações entre enzima e substrato, consequentemente, aumentando a velocidade da reação. A temperatura pode aumentar a energia cinética das moléculas, aumentando a velocidade da reação, porém com o aumento do calor pode desnaturar as enzimas presentes na reação. Outro fator que pode influenciar a velocidade da reação é a concentração de substrato que está atuando, pois a enzima possui múltiplos sítios para ligação de substrato, logo quanto mais substrato, mais sítios serão ocupados e maior será a velocidade da reação.
Especificidade
As enzimas possuem normalmente uma alta especificidade em relação às reações que catalizam e aos substratos que estão envolvidos nessas reações. A forma complementar, carga e características hidrofílicas/hidrofóbicas, são responsáveis por esta especificidade. As enzimas exibem também elevados níveis de estereoespecificidade, regioselectividade e quimioselectividade.
Algumas das enzimas que apresentam maior especificidade e precisão, estão envolvidas na cópia e expressão do genoma. Estas enzimas possuem mecanismos de proof-reading (revisão). Um destes casos é a DNA polimerase, que cataliza uma reação num primeiro passo, para de seguida confirmar, num segundo passo, se o produto é o correto. Este processo em duas etapas resulta em médias de taxa de erro muito diminutas, na ordem de uma para cem milhões de reações, no caso de polimerases de mamíferos. Mecanismos de revisão similares também podem ser encontrados na RNA polimerase, na aminoacil-tRNA sintetases e em ribossomas.
Algumas enzimas que produzem metabolitos secundários são descritos como promíscuos, visto que podem atuar num largo espectro de diferentes substratos. Tem sido sugerido que este tipo de especificidade alargada é importante nos processos de evolução de novas vias de biossíntese.
Modelo chave-fechadura
As enzimas exibem uma elevada especificidade, e foi sugerido por Emil Fischer, em 1894, que esse facto era devido a que tanto as enzimas como os substratos apresentam formas geométricas complementares, fazendo com que encaixem de maneira precisa umas nos outros. Este processo é muitas vezes referido como modelo chave-fechadura. No entanto, apesar deste modelo explicar a especificidade das enzimas, falha em explicar a estabilização dos estados de transição que as enzimas exibem.
Modelo do encaixe induzido
Diagramas que mostram a atividade enzimática através do modelo do encaixe induzido.
Em 1958, Daniel Koshland sugeriu uma modificação ao modelo de chave-fechadura: uma vez que as enzimas exibem estruturas flexíveis, o sítios ativo altera a sua forma de maneira continuada através de interações com o substrato, enquanto esse mesmo substrato vai interagindo com a enzima. Como resultado, o substrato não se liga simplesmente a um sítio ativo que é rígido. As cadeias laterais dos aminoácidos que formam o sítios ativo sofrem um reorientação de maneira a que as suas posições potenciem a ação catalítica da enzima. Em alguns casos, como nas glicosidases, a molécula de substrato também sofre alterações de conformação à medida que vai se aproximando do sítio ativo. O sítio ativo continua a sofrer modificações até que o substrato esteja completamente ligado e é neste momento em que a conformação final e a carga são determinadas.
Mecanismos
As enzimas atuam de diversas formas, todas elas baixando o valor de ΔG‡:25
Baixando a energia de ativação, através da criação de um ambiente no qual o estado de transição é estabilizado (por exemplo, distorcendo a forma da molécula do substrato - a enzima distorce o substrato, gastando energia neste passo, de modo a baixar a energia do estado de transição da reação catalisada, resultando numa diminuição global da energia requerida para completar a reação).
Providenciando uma via alternativa (por exemplo, reagindo com o substrato formando um complexo enzima-substrato, de existência impossível sem a presença da enzima).
Reduzindo a variação da entropia da reação ao orientar os substratos de forma correta para facilitar a reação. Na ausência de enzima, as moléculas colidem em todas as direções possíveis de forma aleatória, um processo menos eficiente que na presença da enzima. Ao considerar-se ΔH‡ isoladamente, este aspecto é negligenciado.
O mecanismo de regulação da atividade enzimática pode ser lento, quando a regulação apresenta aumento ou diminuição de síntese de enzimas, ou rápido que é por meio molecular, ou seja, por ligações de moléculas na enzima ou no substrato, podendo ser também por ligações covalentes “fosforilação”.
Dinâmica e funções
Investigações recentes providenciaram novos conhecimentos sobre a ligação entre a dinâmica interna de uma enzima e o seu mecanismo de catálise. A dinâmica interna de uma enzima é descrita como o movimento de partes internas (como aminoácidos individuais, grupos de aminoácidos, um laço da cadeia, uma hélice alfa, folhas beta vizinhas ou até domínios proteicos inteiros) destas biomoléculas, que podem ocorrer a diversas escalas de tempo, desde femtossegundos a segundos. Redes de resíduos de aminoácidos de uma estrutura podem contribuir para a catálise através de movimentos dinâmicos. Os movimentos em proteínas são importantes para diversas enzimas mas o tipo de reação que elas catalisam determina que tipos de movimento são mais importantes: pequenas e rápidas vibrações ou lentas e significativas alterações conformacionais. Estes estudos têm consequências na compreensão dos efeitos alostéricos, na produção industrial de enzimas e no desenvolvimento de novos fármacos.
Regulação alostérica
As enzimas alostéricas mudam a sua estrutura aquando da ligação de determinadas moléculas. A modulação da atividade da enzima pode ser direta, quando a molécula se liga diretamente a um local de ligação na enzima, ou indireta, quando a molécula se liga a outras proteínas ou subunidades que interagem com a enzima alostérica, influenciando então a sua atividade.
A enzima alostérica possui ,além do sítio ativo específico, um sítio de ligação de moléculas, denominado sítio alostérico. Nesse sítio pode se ligar os produtos da reação para realizar um “feedback” negativo da reação e regulá-la melhor, podendo se ligar também efetores (inibidores) que aumentam ou diminuem a afinidade da enzima e substrato. O substrato pode se ligar ao sítio alostérico, denominado fenômeno de cooperação, o que dá característica ao gráfico das enzimas alostéricas. Existem também enzimas que atuam com o mesmo substrato realizando a mesma reação, porém com algumas diferenças. Essas possuem sítio ativo específico para o mesmo substrato, entretanto apresentam regulações alostéricas distintas, são denominadas isoenzimas.
CLASSIFICAÇÃO DAS ENZIMAS
As enzimas podem ser classificadas de acordo com vários critérios. O mais importante foi estabelecido pela União Internacional de Bioquímica (IUB), e estabelece 6 classes:

*
Transferases : Enzimas que catalisam as reações de transferência de grupamentos funcionais.

*
Oxidorredutases: São enzimas que catalisam reações de transferência de elétrons, ou seja: reações de oxi-redução. São as Desidrogenases e as Oxidases.

*
Se uma molécula se reduz, tem que haver outra que se oxide.
Transferases : Enzimas que catalisam as reações de transferência de grupamentos funcionais.

*
Hidrolases : Catalisam reações de hidrólise de ligação mais fortes como as covalente.

*

*
Liases: Catalisam a quebra de ligações covalentes e a remoção de moléculas de água, amônia e gás carbônico. As Dehidratases e as Descarboxilases são bons exemplos.

*

*
Isomerases: Catalisam reações de interconversão entre isômeros ópticos ou geométricos. As Epimerases são exemplos.

*

*

Ligases: Catalisam reações de formação e novas moléculas a partir da ligação entre duas já existentes, sempre às custas de energia (ATP). São as Sintetases.

*
PROPRIEDADES DAS ENZIMAS
São catalisadores biológicos extremamente eficientes e aceleram em média 109 a 1012 vezes a velocidade da reação, transformando de 100 a 1000 moléculas de substrato em produto por minuto de reação.
Atuam em concentrações muito baixas e em condições suaves de temperatura e pH.
Possuem todas as características das proteínas. Podem ter sua atividade regulada. Estão quase sempre dentro da célula, e compartimentalizadas.
COFATORES ENZIMÁTICOS E COENZIMAS
Cofatores são pequenas moléculas orgânicas ou inorgânicas que podem ser necessárias para a função de uma enzima. Estes cofatores não estão ligados permanentemente à molécula da enzima mas, na ausência deles, a enzima é inativa.
A fração protéica de uma enzima, na ausência do seu cofator, é chamada de apoenzima.
Enzima + Cofator, chamamos de holoenzima.
*
 |  |
Coenzimas são compostos orgânicos, quase sempre derivados de vitaminas, que atuam em conjunto com as enzimas. Podem atuar segundo 3 modelos:
Ligando-se à enzima com afinidade semelhante à do substrato.
Atuando de maneira intermediária aos dois extremos acima citados.
ESPECIFICIDADE SUBSTRATO \ ENZIMA
As enzimas são muito específicas para os seus substratos. Esta especificidade pode ser relativa a apenas um substrato ou a vários substratos ao mesmo tempo.
Esta especificidade se deve à existência, na superfície da enzima de um local denominado sítio de ligação do substrato. O sítio de ligação do substrato de uma enzima é dado por um arranjo tridimensional especial dos aminoácidos de uma determinada região da molécula, geralmente complementar à molécula do substrato, e ideal espacial e eletricamente para a ligação do mesmo. O sítio de ligação do substrato é capaz de reconhecer inclusive isômeros óticos "D" e "L" de um mesmo composto. Este sítio pode conter um segundo sítio, chamado sítio catalítico ou sítio ativo, ou estar próximo dele; é neste sítio ativo que ocorre a reação enzimática.

*

*
Composto que é transformado por uma enzima que se une a uma zona ativa, onde se produz ima catálise, que no exemplo conduz a uma formação de produtos.

*

*
A zona sombreada são os aminoácidos desta enzima (proteína) que configuram, neste caso, o centro ativo da enzima.
Alguns modelos procuram explicar a especificidade substrato/enzima:
- Modelo Chave/Fechadura que prevê um encaixe perfeito do substrato no sítio de ligação, que seria rígido como uma fechadura. No exemplo da figura abaixo, uma determinada região da proteína - o módulo SH2 - liga-se à tirosina fosfatada, que se adapta ao sítio ativo da enzima tal como uma chave faz a sua fechadura.


- Modelo do Ajuste Induzido que prevê um sítio de ligação não totalmente pré-formado, mas sim moldável à molécula do substrato; a enzima se ajustaria à molécula do substrato na sua presença.

 **
**

 **
**
- Evidências experimentais sugerem um terceiro modelo que combina o ajuste induzido a uma "torção" da molécula do substrato, que o "ativaria" e o prepararia para a sua transformação em produto.
Na inibição acompetitiva, o inibidor não se pode ligar à enzima no estado livre, mas somente ao complexo E-S. O complexo E-I-S assim formado, é enzimaticamente inactivo. Este tipo de inibição é raro, mas pode ocorrer em enzima multiméricas.
Em muitos organismos, os inibidores podem agir como parte do mecanismo de retroalimentação. Se uma enzima produz um determinada substância em demasia, essa substância poderá agir como inibidor da enzima, no início da via que a produz, causando a redução ou paragem da produção da substância quando esta se acumula. Esta é um forma de retroalimentação negativa. Enzimas que estão sujeitas a esta forma de regulação são muitas vezes multiméricas e possuem sítios de ligação alostéricos para substâncias reguladoras. Os seus gráficos substrato/velocidade não têm a forma hiperbólica mas sim forma sigmóide (curva em forma de S)
Os inibidores irreversíveis reagem com a enzima e formam ligações covalentes com a cadeia polipeptídica. Este tipo de inactivação é irreversível. Um exemplo de inibidor irreversível é a eflornitina, uma substância utilizada no tratamento da doença do sono . A penicilina e a aspirina também actuam deste modo. Nestes casos, o composto liga-se ao centro activo e a enzima converte-o a uma forma activada que reage irreversivelmente com um ou mais resíduos de aminoácidos.
O ácido fólico e a droga anticancerígena metotrexato são semelhantes na sua estrutura. Como resultado, o metotrexato é um inibidor competitivo de muitas das enzimas que utilizam os folatos.
Um exemplo de um inactivador que é usado como medicamento é a aspirina, que inibe a ciclooxigenase 1 e a ciclooxigenase 2, que são enzimas que produzem um mensageiro que age em casos de inflamação, neste caso uma prostaglandina, suprimindo assim a dor e a inflamação. O cianureto é um inactivador enzimático irreversível, que se combina com cobre e zinco no sítio activo da enzima citocromo c oxidase, bloqueando a respiração celular.
Inibição
Exemplo de uma reação normal (a) e de uma inibição reversível competitiva (b), em que o substrato e o inibidor competem pela enzima. Numa reação normal, o Substrato liga-se ao centro Ativo da Enzima (1), provocando a libertação de produtos por parte da enzima (2). Quanto à inibição, o Inibidor liga-se à enzima (3), não permitindo ao substrato ter acesso à mesma (4), logo não havendo reação e não sendo produzidos quaisquer produtos.
Inibição competitiva
Na inibição competitiva, o inibidor e o substrato competem pela enzima, isto é, não se podem ligar ao mesmo tempo à enzima. Os inibidores são muitas vezes semelhantes ao substrato da enzima. Por exemplo, o metotrexato é um inibidor competitivo da enzima dihidrofolato redutase, que cataliza a redução do dihidrofolato em tetrahidrofolato. A similitude entre as estruturas do ácido fólico e desta droga são mostradas na figura adjacente. Notar que o local de ligação do inibidor não é necessariamente o mesmo que o local de ligação do inibidor, se a ligação de este último mudar a conformação da enzima com vista a impedir a ligação do substrato, e vice versa. Na inibição competitiva, a velocidade máxima da reacção não é alterada, mas níveis mais altos de concentração do substrato são requeridos para que se atinja uma determinada velocidade, aumentando o KM aparente.
- Inibição acompetitiva ou incompetitiva
- Inibição não-competitiva
- Inibição mista
Em muitos organismos, os inibidores podem agir como parte do mecanismo de retroalimentação. Se uma enzima produz um determinada substância em demasia, essa substância poderá agir como inibidor da enzima, no início da via que a produz, causando a redução ou paragem da produção da substância quando esta se acumula. Esta é um forma de retroalimentação negativa. Enzimas que estão sujeitas a esta forma de regulação são muitas vezes multiméricas e possuem sítios de ligação alostéricos para substâncias reguladoras. Os seus gráficos substrato/velocidade não têm a forma hiperbólica mas sim forma sigmóide (curva em forma de S)
O ácido fólico e a droga anticancerígena metotrexato são semelhantes na sua estrutura. Como resultado, o metotrexato é um inibidor competitivo de muitas das enzimas que utilizam os folatos.
Usos de inativadores
Os inativadores são muitas vezes usados como medicamentos, mas também poderão actuar como venenos. No entanto, a diferença entre um medicamento e um veneno é normalmente uma questão de dosagem, visto que a maior parte dos medicamentos e drogas são tóxicas a partir de certo nível. Como Paracelso disse: "Todas as coisas são um veneno e nada existe sem veneno, apenas a dosagem é razão para que uma coisa não seja um veneno" igualmente, os antibióticos e outras drogas anti-infecciosas são apenas venenos que matam o agente patogénicos e não o hospedeiro deste.Um exemplo de um inactivador que é usado como medicamento é a aspirina, que inibe a ciclooxigenase 1 e a ciclooxigenase 2, que são enzimas que produzem um mensageiro que age em casos de inflamação, neste caso uma prostaglandina, suprimindo assim a dor e a inflamação. O cianureto é um inactivador enzimático irreversível, que se combina com cobre e zinco no sítio activo da enzima citocromo c oxidase, bloqueando a respiração celular.
MECANISMO GERAL DE CATÁLISE
As enzimas aceleram a velocidade de uma reação por diminuir a energia livre de ativação da mesma, sem alterar a termodinâmica da reação, ou seja: A energia dos reagentes e produtos da reação enzimática e de sua equivalente não enzimática são idênticas.
Para se superar a energia de ativação de uma reação, passa-se pela formação de um estado intermediário chamado "Estado de Transição", sempre um composto instável e de alta energia, representado por "Ts", ligado com altíssima afinidade ao sítio catalítico. Nas reações enzimáticas, este composto de transição "Ts" não pode ser isolado ou mesmo considerado um intermediário, uma vez que não é liberado para o meio de reação; sua formação ocorre no sítio catalítico da enzima!! Como a afinidade do "Ts" ao sítio catalítico é muito maior que a afinidade do substrato com o mesmo, a pequena quantidade de moléculas em "Ts" será rapidamente convertida em produto. Assim, todo o fator que leva a um aumento do número de moléculas em "Ts" aumenta a velocidade da reação.
São 4 os mecanismos principais através dos quais as enzimas aceleram uma reação, aumentando a formação de moléculas de substrato em "Ts":
Catálise Ácido-Base que ocorre com a participação de aminoácidos com cadeias laterais ionizáveis, capazes de doar ou liberar prótons durante a catálise.
Torção de Substrato, que depende da torção do substrato induzida pela ligação do mesmo com o sítio de ligação da enzima, alcançando o estado de transição e estimulando sua conversão em produto.
Catálise Covalente que resulta do ataque nucleofílico ou eletrofílico de um radical do sítio catalítico sobre o substrato, ligando-o covalentemente à enzima e induzindo a sua transformação em produto. Envolve com freqüência a participação de coenzimas.
Efeito de Diminuição da Entropia. As enzimas ajudam no posicionamento e na definição da estequiometria correta da reação, facilitando os mecanismos anteriores.
Tal com acontece com todos os compostos catalisadores, as enzimas não alteram a posição do equilíbrio químico da reacção. Normalmente, na presença de uma enzima, a reacção desenvolve-se na mesma direcção que se seria tomada se ela não estivesse presente, mas de maneira mais rápida. no entanto, Na ausência da enzima, as reacções poderão dar origem a diferentes produtos, porque nessas condições esses produtos são formados de maneira mais rápida.
Para além disso, as enzimas podem executar duas ou mais reacções, de tal maneira que a actuação numa reacção termodinamicamente favorável possa facilitar a actuação numa reacção menos favorável. Por exemplo, a energia disponibilizada pela hidrólise do ATP é normalmente utilizada para executar outras reacções.
As enzimas catalisam as reacções em ambos os sentidos. Elas não alteram o equilíbrio em si, mas a velocidade em que este é alcançado. Por exemplo, a anidrase carbónica catalisa a sua reacção nas duas direcções, dependendo da concentração dos seus reagentes.
Termodinâmica
Diagrama de uma reacção catalítica, mostrando o nível de energia em cada etapa da reacção. Normalmente, o substrato necessita de uma quantidade elevada de energia para conseguir chegar ao estado de transição, decaindo depois até a um produto final. A enzima estabiliza o estado de transição, reduzindo o valor de energia necessário para que se formem os produtos. A linha a vermelho (cheio) representa a reacção na ausência de catalisador; a azul (tracejado), na presença de enzima. S: nível de energia do(s) substrato(s); P: nível de energia do(s) produto(s); G: energia de Gibbs; R: coordenada de reacção (sentidos de progressão de reacção); ΔG'º: energia livre padrão bioquímica; ΔG‡: energia de activação (S-P: do(s) substrato(s); P-S: do(s) produto(s)).
Para além disso, as enzimas podem executar duas ou mais reacções, de tal maneira que a actuação numa reacção termodinamicamente favorável possa facilitar a actuação numa reacção menos favorável. Por exemplo, a energia disponibilizada pela hidrólise do ATP é normalmente utilizada para executar outras reacções.
As enzimas catalisam as reacções em ambos os sentidos. Elas não alteram o equilíbrio em si, mas a velocidade em que este é alcançado. Por exemplo, a anidrase carbónica catalisa a sua reacção nas duas direcções, dependendo da concentração dos seus reagentes.
 (em tecidos; alta concentração de CO2)
(em tecidos; alta concentração de CO2)
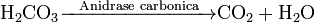 (nos pulmões; baixa concentração de CO2)
(nos pulmões; baixa concentração de CO2)
Cinética
A cinética enzimática é o estudo do mecanismo pelo qual as enzimas ligam substratos e os transformam em produtos. São utilizados dados sobre a velocidade de reação de enzimas através de ensaios enzimáticos.
Em 1902, Victor Henri propôs uma teoria quantitativa de cinética enzimática, mas os seus dados experimentais tinham pouca utilidade porque não era então considerada a importância da concentração do ião H+. Depois de Peter Lauritz Sørensen definir a escala logarítmica de pH e introduzir o conceito de solução tampão em 1909 , o químico alemão Leonor Michaelis e a sua pós-doc canadiana Maud Leonora Menten repetiram as experiências de Henri e confirmaram a sua equação, sendo esta cinética conhecida como cinética de Henri-Michaelis-Menten (muitas vezes simplificado para cinética de Michaelis-Menten). Este trabalho foi desenvolvido por G. E. Briggs e J. B. S. Haldane, que derivaram equações cinéticas usadas ainda hoje em dia .
Henri contribuiu significativamente para este campo ao teorizar as reacções enzimáticas ocorrendo em dois passos. No primeiro, o substrato liga-se de forma reversível à enzima, formando o complexo enzima-substrato. Este complexo é por vezes designado complexo de Michaelis. A enzima catalisa então o passo químico da reacção e liberta o produto.
As enzimas podem catalisar até vários milhões de reacções por segundo. Por exemplo, a reacção catalisada pela orotidina 5'-fosfato descarboxilase tem uma semivida de 78 milhões de anos na ausência de enzima, diminuindo para apenas 25 milissegundos na presença desta. As velocidades de reacção dependem das condições em que as enzimas se encontram e da concentração de substrato. Condições de alta temperatura, pH extremos ou altas concentrações salinas desestabilizam a estrutura da proteína, desnaturando-a. Por outro lado, em geral, um aumento na concentração de substrato tende a aumentar a actividade enzimática.
Experimentalmete, encontra-se a velocidade máxima de reacção aumentando progressivamente a concentração de substrato, até se verificar uma velocidade constante de formação de produto. Tal é visível na curva de saturação do gráfico à direita. A saturação acontece porque, à medida que é aumentada a concentração de substrato, aumenta também a quantidade de enzima presente sob a forma de complexo enzima-substrato (ES). À velocidade máxima, Vmax, todos os centros activos estão ocupados (saturados) com substrato, ou seja, não existe enzima livre para ligar mais substrato e a concentração de complexo ES é igual à concentração de enzima.
A actividade de uma enzima é geralmente descrita através de Vmax e também da constante de Michaelis-Menten, KM, que representa a concentração de substrato à qual se detecta uma velocidade de reacção igual a metade de Vmax. Cada enzima possui um KM característico para um dado substrato; este parâmetro é muitas vezes usado para demonstrar a força de ligação de um substrato à enzima. É também usada outra constante cinética, kcat, para descrever o comportamento de uma enzima, representando o número de moléculas de substrato que podem ser catalisadas por centro activo por segundo.
A eficiência catalítica de uma enzima pode ser expressa através da constante de especificidade, igual à razão kcat/Km. A constante de especificidade relaciona-se tanto com a afinidade da ligação do substrato à enzima como com a capacidade catalítica desta, pelo que se torna útil para a comparação entre diferentes enzimas, ou a mesma enzima com diferentes substratos. Existe um valor máximo teórico para esta constante, cerca de 108 to 109 M−1 s−1, denominado limite de difusão. Considerando-se que cada colisão entre enzima e substrato resulta em catálise, a velocidade global de formação do produto não será limitada pela velocidade de reacção da enzima mas sim pela velocidade de difusão das moléculas em solução. Enzimas que possuam uma constante de especificidade perto deste valor são designadas enzimas cataliticamente (ou cineticamente) perfeitas; alguns exemplos incluem as enzimas triose fosfato isomerase, anidrase carbónica, acetilcolinesterase, catalase, fumarase, ß-lactamase e superóxido dismutase.
A cinética de Michaelis-Menten baseia-se na lei da acção das massas, que é derivada das assunções sobre difusão livre e sobre colisões aleatórias com base termodinâmica. No entanto, muitos dos processos bioquímicos ou celulares não se comportam da forma prevista por estes modelos devido à alta concentração de substâncias no meio celular, separação de fases entre enzima, substrato e produto e restrição do movimento molecular a uma ou duas dimensões. Nestas situações, é aplicável um modelo fractal da cinética de Michaelis-Menten.
Algumas enzimas apresentam cinética mais veloz que as velocidades de difusão, no que aparenta ser uma impossibilidade. Diversos mecanismos foram usados como razão para explicar este fenómeno. Uma explicação é a de algumas enzimas acelerarem a sua catálise ao captar e orientar o seu substrato usando dipolos eléctricos. Outros modelos usam um mecanismo quântico-mecânico de tunneling, em que um protão ou electrão podem atravessar barreiras de activação, embora o modelo de tunneling de protões seja controverso, tendo sido no entanto observado na triptamina . Estes modelos sugerem que a catálise enzimática seja possivelmente melhor descrita em termos de "atravessar um barreira" em detrimento do modelo tradicional de "passar por cima" de uma barreira energética diminuída.
Mecanismo de reacção de uma enzima com substrato único. A enzima (E) liga o substrato (S) e liberta o produto (P).
Em 1902, Victor Henri propôs uma teoria quantitativa de cinética enzimática, mas os seus dados experimentais tinham pouca utilidade porque não era então considerada a importância da concentração do ião H+. Depois de Peter Lauritz Sørensen definir a escala logarítmica de pH e introduzir o conceito de solução tampão em 1909 , o químico alemão Leonor Michaelis e a sua pós-doc canadiana Maud Leonora Menten repetiram as experiências de Henri e confirmaram a sua equação, sendo esta cinética conhecida como cinética de Henri-Michaelis-Menten (muitas vezes simplificado para cinética de Michaelis-Menten). Este trabalho foi desenvolvido por G. E. Briggs e J. B. S. Haldane, que derivaram equações cinéticas usadas ainda hoje em dia .
Henri contribuiu significativamente para este campo ao teorizar as reacções enzimáticas ocorrendo em dois passos. No primeiro, o substrato liga-se de forma reversível à enzima, formando o complexo enzima-substrato. Este complexo é por vezes designado complexo de Michaelis. A enzima catalisa então o passo químico da reacção e liberta o produto.
Curva de saturação numa reacção enzimática, mostrando a relação entre a concentração de substrato ([S]) e a velocidade (V).
Experimentalmete, encontra-se a velocidade máxima de reacção aumentando progressivamente a concentração de substrato, até se verificar uma velocidade constante de formação de produto. Tal é visível na curva de saturação do gráfico à direita. A saturação acontece porque, à medida que é aumentada a concentração de substrato, aumenta também a quantidade de enzima presente sob a forma de complexo enzima-substrato (ES). À velocidade máxima, Vmax, todos os centros activos estão ocupados (saturados) com substrato, ou seja, não existe enzima livre para ligar mais substrato e a concentração de complexo ES é igual à concentração de enzima.
A actividade de uma enzima é geralmente descrita através de Vmax e também da constante de Michaelis-Menten, KM, que representa a concentração de substrato à qual se detecta uma velocidade de reacção igual a metade de Vmax. Cada enzima possui um KM característico para um dado substrato; este parâmetro é muitas vezes usado para demonstrar a força de ligação de um substrato à enzima. É também usada outra constante cinética, kcat, para descrever o comportamento de uma enzima, representando o número de moléculas de substrato que podem ser catalisadas por centro activo por segundo.
A eficiência catalítica de uma enzima pode ser expressa através da constante de especificidade, igual à razão kcat/Km. A constante de especificidade relaciona-se tanto com a afinidade da ligação do substrato à enzima como com a capacidade catalítica desta, pelo que se torna útil para a comparação entre diferentes enzimas, ou a mesma enzima com diferentes substratos. Existe um valor máximo teórico para esta constante, cerca de 108 to 109 M−1 s−1, denominado limite de difusão. Considerando-se que cada colisão entre enzima e substrato resulta em catálise, a velocidade global de formação do produto não será limitada pela velocidade de reacção da enzima mas sim pela velocidade de difusão das moléculas em solução. Enzimas que possuam uma constante de especificidade perto deste valor são designadas enzimas cataliticamente (ou cineticamente) perfeitas; alguns exemplos incluem as enzimas triose fosfato isomerase, anidrase carbónica, acetilcolinesterase, catalase, fumarase, ß-lactamase e superóxido dismutase.
A cinética de Michaelis-Menten baseia-se na lei da acção das massas, que é derivada das assunções sobre difusão livre e sobre colisões aleatórias com base termodinâmica. No entanto, muitos dos processos bioquímicos ou celulares não se comportam da forma prevista por estes modelos devido à alta concentração de substâncias no meio celular, separação de fases entre enzima, substrato e produto e restrição do movimento molecular a uma ou duas dimensões. Nestas situações, é aplicável um modelo fractal da cinética de Michaelis-Menten.
Algumas enzimas apresentam cinética mais veloz que as velocidades de difusão, no que aparenta ser uma impossibilidade. Diversos mecanismos foram usados como razão para explicar este fenómeno. Uma explicação é a de algumas enzimas acelerarem a sua catálise ao captar e orientar o seu substrato usando dipolos eléctricos. Outros modelos usam um mecanismo quântico-mecânico de tunneling, em que um protão ou electrão podem atravessar barreiras de activação, embora o modelo de tunneling de protões seja controverso, tendo sido no entanto observado na triptamina . Estes modelos sugerem que a catálise enzimática seja possivelmente melhor descrita em termos de "atravessar um barreira" em detrimento do modelo tradicional de "passar por cima" de uma barreira energética diminuída.
FATORES EXTERNOS QUE INFLUENCIAM NA VELOCIDADE DE UMA REAÇÃO ENZIMÁTICA
São eles:
Temperatura: Quanto maior a temperatura, maior a velocidade da reação, até se atingir a temperatura ótima; a partir dela, a atividade volta a diminuir, por desnaturação da molécula.
pH: Idem à temperatura; existe um pH ótimo, onde a distribuição de cargas elétricas da molécula da enzima e, em especial do sítio catalítico, é ideal para a catálise.
As enzimas exercem uma grande variedade de funções nos organismos vivos. São indispensáveis para a transdução de sinais, na regulação celular, muitas vezes por ação de cinases e fosfatases. Através da sua ação podem gerar movimento, como no caso da miosina que hidroliza ATP, gerando contracções musculares. Também movimentam carga através da célula, através da acção do citoesqueleto. Algumas enzimas são ATPases (funcionam como bombas iónicas), que se localizam na membrana celular, estando envolvidas do processo de transporte activo. Algumas funções mais exóticas são operadas por enzimas, como é o caso da luciferase que gera luz nos pirilampos.56 Os vírus podem conter enzimas que auxiliam na infecção de células (HIV-integrase e transcriptase reversa) ou na libertação celular de vírus (neuraminidase no vírus influenza).
As enzimas contribuem enormemente para inúmeras indústrias. Enzimas de processamento alimentar tais como a glucoamilase podem reduzir o alimento em glicose.
Uma aplicação industrial é a produção de antibióticos em larga escala. Encontram-se também determinados tipos de enzimas em produtos de limpeza, para ajudar a digerir gorduras e proteínas presentes em nódoas.
Também são usadas em investigação laboratorial e na medição de concentrações de substâncias com interesse clínico.
Funções biológicas
A ação da luciferase induz bioluminiscência nos pirilampos.
As enzimas exercem uma grande variedade de funções nos organismos vivos. São indispensáveis para a transdução de sinais, na regulação celular, muitas vezes por ação de cinases e fosfatases. Através da sua ação podem gerar movimento, como no caso da miosina que hidroliza ATP, gerando contracções musculares. Também movimentam carga através da célula, através da acção do citoesqueleto. Algumas enzimas são ATPases (funcionam como bombas iónicas), que se localizam na membrana celular, estando envolvidas do processo de transporte activo. Algumas funções mais exóticas são operadas por enzimas, como é o caso da luciferase que gera luz nos pirilampos.56 Os vírus podem conter enzimas que auxiliam na infecção de células (HIV-integrase e transcriptase reversa) ou na libertação celular de vírus (neuraminidase no vírus influenza).
Uma importante função das enzimas tem lugar no sistema digestivo dos animais. Enzimas como as amilases e proteases, quebram grandes moléculas como o amido e proteínas, respectivamente, em moléculas de menores dimensões, de maneira a que estas possam ser absorvidas no intestino. O amido não é absorvível no intestino, mas as enzimas hidrolizam as cadeias de amido em moléculas menores tais como a maltose e a glucose, podendo desta maneira ser absorvidas. Diferentes enzimas actuam sobre diferentes tipos de alimento. Nos ruminantes, que possuem uma dieta herbívora, bactérias no sistema digestivo produzem uma enzima denominada celulase que quebra as paredes celulares das células vegetais.
As enzimas podem trabalhar em conjunto, seguindo uma ordem de atuação específica. Desta maneira podem formar vias metabólicas. Nestas vias, uma enzima processa o produto da ação de outra enzima como o seu substrato. Após a reação catalítica, o produto é depois entregue a outra enzima. Por vezes, mais do que uma enzima pode catalisar a mesma reação, em paralelo. Isto permite uma regulação mais complexa:
As enzimas determinam que passos é que ocorrem nessa vias metabólicas. Sem a presença de enzimas, o metabolismo não progride através dos mesmo passos, nem é suficientemente rápido para que sirva as necessidades da célula. De facto, uma via metabólica tão importante como a glicólise não poderia existir sem a presença de enzimas. A glucose, por exemplo, pode reagir diretamente com o ATP para dar origem a um produto fosforilado em um ou mais carbonos. Na ausência de enzimas, este processo é tão lento que se torna insignificante. No entanto, se a enzima hexocinase for adicionada, estas reação lentas continuam a ser efetuadas, mas a fosforilação do carbono número 6 ocorre de maneira tão rápida que, se a mistura for testada pouco tempo depois, a glicose-6-fosfato o único produto significativo. Consequentemente, pode-se dizer que a rede de vias metabólicas existentes dentro de cada célula depende do conjunto de enzimas funcionais que estão presentes
Aplicações
Enzimas digestivas tais como a amilase, protease e lipase, reduzem os alimentos em componentes menores que são mais facilmente absorvidos no trato digestivo.As enzimas contribuem enormemente para inúmeras indústrias. Enzimas de processamento alimentar tais como a glucoamilase podem reduzir o alimento em glicose.
Uma aplicação industrial é a produção de antibióticos em larga escala. Encontram-se também determinados tipos de enzimas em produtos de limpeza, para ajudar a digerir gorduras e proteínas presentes em nódoas.
Também são usadas em investigação laboratorial e na medição de concentrações de substâncias com interesse clínico.








Nenhum comentário:
Postar um comentário